概述
宫颈上皮内瘤变(cervical intraepithelial neoplasias,CIN)是一组与宫颈浸润癌密切相关的癌前期病变的统称。包括宫颈不典型增生和宫颈原位癌,反映了宫颈癌发生中连续发展的过程,即由宫颈不典型增生(轻→中→重)→原位癌→早期浸润癌→浸润癌的一系列病理变化。目前CIN已被国内外病理学者和妇科肿瘤学者所接受。 1.宫颈不典型增生(dysplasia) 是指宫颈上皮细胞部分或绝大部分被不同程度的异型细胞所替代。已被公认为宫颈癌癌前病变的宫颈不典型增生,可发生于宫颈外口附近的移行区或宫颈管内膜。曾有不同的名称,如间变(anaplasia)、核异常(dyska...[详细]
病因
1.人类乳头状瘤病毒感染 近年来随着人类乳头状瘤病毒(HPV)感染与下生殖道关系研究的不断深入,发现HPV感染与子宫颈癌前病变的发生有着一定的关联。HPV感染作为一种特殊类型的性传播疾病是子宫颈上皮内瘤样病变发生的病因。分子生物学及流行病学研究表明人类乳头状瘤病毒有致癌性。HPV根据其致癌性不同可分为不同类型:HPV16,18,45,56为高危型,HPV31,33,35等11种为中危型,HPV6,11,26等8种为低危型。CINⅠ及亚临床HPV感染常为HPV6,11型,CINⅢ80%为HPV16型感染。 子宫颈重度不典型增生其细胞内染色体常伴有HPV基因的整合,从而启动E1、E2...[详细]
发病机制
1.宫颈不典型增生 鳞状上皮不典型增生细胞既具有异型性,又保持分化能力。镜下特点为:①细胞核增大、深染,大小形态不一;②染色质增多、粗大;③核浆比例增大;④核分裂增多;⑤细胞极性紊乱至消失。根据细胞异型程度及上皮累及范围,宫颈不典型增生又分为轻、中、重三度(或三级)。 (1)轻度不典型增生(或称Ⅰ级):细胞异型性轻,异常增生的细胞仅限于上皮层的下1/3,中、表层细胞正常。 (2)中度不典型增生(或称Ⅱ级):细胞异型性明显,异常增生的细胞限于上皮层的下2/3,未累及表层。 (3)重度不典型增生(或称Ⅲ级):细胞异型性显著,异常增生的细胞占据上皮内2/3以上或...[详细]
临床表现
CIN一般无明显症状和体征,部分有白带增多、白带带血、接触性出血及宫颈肥大、充血、糜烂、息肉等慢性宫颈炎的表现,正常宫颈也占相当比例(10%~50%),故单凭肉眼观察无法诊断CIN,见表2。多数文献报道约半数原位癌患者无临床症状。舒仪经(1995)统计172例原位癌,仅5.2%有接触性出血,12.2%有少量的不规则出血,其余无症状。李楠等(2001)统计150例CIN中,白带增多和接触性出血者分别占26.0%和20.7%,无症状者占38.0%。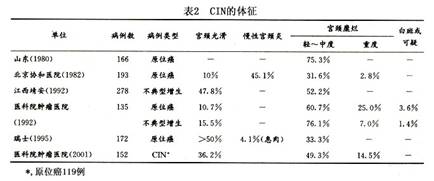

并发症
不典型增生原位癌常与浸润癌并存。
实验室检查
1.细胞学检查 自1941年Papanicloaou和Traut创立用阴道脱落细胞学诊断方法以来,长期的临床实践证明此法具有简便易行、经济有效及多次重复的特点,已成为妇科常规检查的重要内容及宫颈癌普查中首选的初筛工具。从临床角度来看以下几点值得重视: (1)诊断的正确率:细胞学阳性确诊率虽达95.4%,但不同作者报道的准确率差异很大(67%~92.6%),且有一定的假阴性和假阳性。检出CIN的假阴性为10%~35%,甚至高达50%(Coppleson,1992)。细胞学诊断的准确性主要取决于以下因素: ①取材部位:是影响涂片质量的关键,常规在宫颈外口的鳞柱交界处取材,但因...[详细]
其他辅助检查
1.阴道镜检查及阴道镜引导下的活检 (1)阴道镜检查:阴道镜检查是一种简单而有效的诊断子宫颈有无病变的方法,肉眼不能看出的异常上皮及异常毛细血管,通过阴道镜检查可清楚地看到。阴道镜下异常上皮的特征包括: ①细胞和细胞核密度的增加。 ②鳞状上皮轮廓不规则,并伴有特殊的血管变化,表现为点状(punctation)或镶嵌(mosaic)。前者是由于上皮内扭曲或弯曲的毛细血管斜行达表面,后者是由于血管扩张,排列成蜂窝状,内上皮岛分开而成。 ③白色上皮是CIN的第一特征,在上皮表面有一层厚的角化蛋白。 阴道镜检查能进一步帮助发现病变部位,从而指导宫颈部位...[详细]
诊断
由于CIN常缺乏典型的临床表现,根据临床检查难以诊断CIN,目前趋于借助多种辅助诊断方法的联合使用,但最后确诊须靠病理检查。宫颈细胞学涂片+宫颈多点活检(碘染、肉眼观察VIA或阴道镜下)+颈管刮术已成为CIN和早期宫颈癌普遍采用的综合早诊方法,近年来早诊技术方面有较大进展。
治疗
1.治疗原则 近代对CIN的治疗策略是趋于保守,原因为:①CIN和早期癌的综合诊断水平提高;②宫颈癌的发生、发展经历较漫长的时间,有10年左右;③有20%~50%的不典型增生发生逆转或自然消退;④绝大多数CIN病灶局限,保守性治疗一次性治愈率高达90%左右;⑤原位癌的5年生存率为100%。但至今国内外对CIN的处理尚存不少争论。 (1)CINⅠ级及宫颈SPI是否治疗,意见不一。CIN自然转归的研究提示级别低的CIN有高的自然逆转率,多数与低危的HPV感染有关,进展为癌的机会极少,近年认为CINⅠ级是一种不稳定状态,对这些最早的癌前病变应采用随诊观察,不予治疗(Jordan,1989...[详细]
预后
Richart曾指出CIN的异型程度越高、累及上皮厚度越深,发展为浸润癌的可能性越大,反之级别低的CIN逆转到正常的机会越多。CIN有三种转归:①消退(或逆转);②持续不变(或病情稳定);③进展(或癌变)。 1.CIN转归相关因素 (1)HPV型别:有研究提示HPV型别是CIN转归的相关因素(Richart等,1987)。持续高危HPV感染发生宫颈癌的危险性增加250倍。Campion等(1986)对100例CINⅠ级随诊2年余,高危HPV 16,18型阳性者,56%进展为CIN Ⅲ级,而低危HPV6型阳性者,仅20%有进展。 (2)CIN程度:随CIN级别...[详细]
预防
有些学者认为不需特殊治疗,可随访观察,因为低的HPV感染而致的阴道镜下所见的轻度病灶,其恶变的机会较小。有些认为应进行治疗,因为少部分CINⅠ为高危型HPV感染,其有赘生性趋向。

 CINⅠ:上皮成熟,核异常少,有丝分裂少见图1。未分化的细胞限于上皮深层(下1/3)。有丝分裂象可见,但不多,HPV感染的细胞病理变化在全层上皮均可观察到。
CINⅠ:上皮成熟,核异常少,有丝分裂少见图1。未分化的细胞限于上皮深层(下1/3)。有丝分裂象可见,但不多,HPV感染的细胞病理变化在全层上皮均可观察到。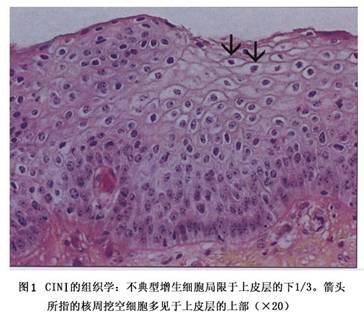 CINⅡ:不典型增生的细胞变化主要在上皮下的1/2或1/3,核异常比CINⅠ明显见图2。上皮下1/2可见到核分裂象。
CINⅡ:不典型增生的细胞变化主要在上皮下的1/2或1/3,核异常比CINⅠ明显见图2。上皮下1/2可见到核分裂象。 CINⅢ:上皮分化和分层可以缺乏或仅在上皮表层的1/4出现并伴有许多核分裂象(图3,4),核异常可遍布上皮全层,许多核分裂象有异常。
CINⅢ:上皮分化和分层可以缺乏或仅在上皮表层的1/4出现并伴有许多核分裂象(图3,4),核异常可遍布上皮全层,许多核分裂象有异常。
 细胞学者、病理学者和阴道镜学者互相沟通可提高三个级别CIN的报告水准。尤其有助于鉴别轻度CIN。
细胞学者、病理学者和阴道镜学者互相沟通可提高三个级别CIN的报告水准。尤其有助于鉴别轻度CIN。 然而鉴于以下原因: ①CIN Ⅲ级进展到癌的机会明显增多,65%以上的重度不典型增生可发展成原位癌,18%~36%的原位癌进展为浸润癌。 ②CIN Ⅲ级常与早期浸润或浸润癌并存,诊断水平的差异可能导致诊断不充分而漏诊。 ③CIN Ⅲ级经保守治疗后需密切随诊,而国内多数患者来自农村,缺乏长期随诊条件等。 因此,对于已无生育要求的CIN Ⅲ级者,全子宫切除是最好的治疗选择。 (3)宫颈锥切术用于原位癌的治疗,迄今仍有不同看法,国外较广泛采用,但文献中多数报道锥切术后复发率高于全子宫切除术后。Demopoulos等(1991)报道96例CIN Ⅲ采用宫颈锥切术,切缘阳性率达39.6%,术后8周行子宫切除术,38.5%有残存病灶。Parson(1978)报道锥切后残余或复发癌为3.2%~9.1%。Coppleson等(1992)收集13位作者的资料,术后残存病灶达12%~60%。Chang曾研究172例宫颈锥切后子宫切除的病理标本,发现锥切边缘阳性和残存病灶的发生率,在高度鳞状上皮内病变(HSIL,包括Ⅱ、Ⅲ级)中分别为18.6%和23.3%,残存病变在锥切边缘阳性中的比例显著高于边缘阴性者,分别为84.8%和10.1%。可见锥切治疗原位癌是不彻底的,并有遗漏浸润癌的可能。近年也有不少报道传统锥切术(CKC)成功地治疗宫颈原位癌(Mohamed等,1997)。 综上所述,CIN的治疗也应遵循个体化原则,治疗方法的选择主要取决于CIN的级别、病变范围、年龄、生育要求、医疗条件及医师的经验等。总的治疗对策为:对CINⅠ、Ⅱ级,采用冷冻、激光等局部治疗;对CIN Ⅲ级,国内以手术切除子宫为主,国外有主张采用局部治疗者。对年轻、有生育要求、病变范围小的CINⅠ级患者可以随访观察,而对病变局限、年轻、有生育要求或要求保留子宫的CIN Ⅲ级者可行锥形切除。 局部治疗CIN的效果主要与下列因素有关:①CIN级别,病变大小;②治疗深度;③整个转化区是否被去除;④合并反复或持续HPV感染(尤其高危型HPV);⑤颈管是否受累;⑥治愈标准、随诊时间、医师经验等。 因此,采用局部治疗需注意以下几点:①治疗前必须详细检查,准确诊断,并须排除浸润癌;②治疗前应做ECC检查;③月经干净后5~7天后进行;④宜在碘染、VIA或阴道镜直视下治疗;⑤治疗达足够深度,不应少于4mm,治疗范围应包括宫颈的全部病变(以超出病变3~5mm为宜)、整个转化区及颈管下段;⑥治疗后应长期随诊,包括细胞学、阴道镜和病理。 2.CIN常用的治疗方法 (1)冷冻治疗(cryosurgery):冷冻治疗CIN的文献报道较多,CINⅠ、Ⅱ级的治愈率可达90%~97%,而CIN Ⅲ级的治疗效果较差,80%~90%,但也有报道达96%(Levine,1985)。Coppleson等(1992)统计15位作者的治疗结果,总治愈率为83.5%,其中CINⅡ、Ⅲ级的治愈率分别为91%和77.8%,说明随CIN级别的增加治愈率明显下降。 冷冻治疗简易有效,冷冻最大的优点就是没有电灼所产生的疼痛。治疗深度与电灼一样,也可达3~4mm。不过,少数病人因为需要重复治疗,尤其在行深部治疗时仍会感觉不舒服,可能是子宫收缩的结果。Richard等人以及其他报道最多的16位作者,都认为用冷冻治疗所有的CIN,失败率为1%~8%。其中CINⅠ是零失败率。值得注意的是,失败后再次冷冻治疗可减少CINⅡ的失败率到3%,减低CIN的失败率到7%。冷冻所采用的冷煤、二氧化碳(carbon dioxide)或一氧化氮(nitrousoxide),结果都是一样。惟治疗时,压力不能低到40kg/cm2。与子宫颈接触的探头(probe)部分,除了中间呈乳突状外,四周应该是4~5mm宽。同时,为了均匀及快速冷冻,探头部分可抹上一层薄薄的水溶性润滑油,则更为理想。 一般认为冷冻治疗宜用于病变局限的CINⅠ、Ⅱ级,为提高治愈、减少复发,冷冻治疗需注意以下几点: ①根据宫颈形态及病变范围等选用相应的冷冻头,应以覆盖整个病灶为宜。冷冻头端应涂一薄层水溶性润滑剂作为介质,提高穿透性,增加与宫颈的均匀接触,使温度迅速传递。 ②冷冻剂用CO2或液氮,温度在-75℃以下,压力是冷冻成败的重要因素,必须始终保持在3.92×106Pa(40kgf/cm2)以上,以保证冷冻能力,探头周围要在1.5~2min内形成保持4~5mm厚度的冷球。 ③应用两次即两个冻融期,以达到较好疗效。 (2)激光治疗:Bellina和Poleshchuk等于20世纪70年代应用CO2激光治疗妇科肿瘤,80年代国内外文献报道治疗CIN的效果,Towensend(1983)比较激光和冷冻治疗CIN(各100例)的结果,失败率分别为11%和7%。Coppleson综合文献一次治愈率为76%~98%。上海医科大学妇产医院报道用激光治疗CIN 220例,转常率为65.5%,高于其他疗法,复发率为5.8%。 激光一般都在阴道镜下操作,所放出的能量由点状光束释出,并由组织吸收,除可摧毁组织并可将其蒸发。激光的触煤也是二氧化碳。连续的治疗比断续的治疗效果要好。深度可达5~7mm。惟治疗时不可用易燃物品,例如酒精、消毒剂等。此外,治疗时产生的烟雾可用吸管吹掉,让视野更清楚一些。除了有组织破坏较深的好处之外,激光至少有两种坏处:比电灼、冷冻还要痛,这是深部组织破坏后的必然现象,也因此而出血较多。依Parashevadis等人的报道,总失败率是5.6%(119/2130)。在40岁
然而鉴于以下原因: ①CIN Ⅲ级进展到癌的机会明显增多,65%以上的重度不典型增生可发展成原位癌,18%~36%的原位癌进展为浸润癌。 ②CIN Ⅲ级常与早期浸润或浸润癌并存,诊断水平的差异可能导致诊断不充分而漏诊。 ③CIN Ⅲ级经保守治疗后需密切随诊,而国内多数患者来自农村,缺乏长期随诊条件等。 因此,对于已无生育要求的CIN Ⅲ级者,全子宫切除是最好的治疗选择。 (3)宫颈锥切术用于原位癌的治疗,迄今仍有不同看法,国外较广泛采用,但文献中多数报道锥切术后复发率高于全子宫切除术后。Demopoulos等(1991)报道96例CIN Ⅲ采用宫颈锥切术,切缘阳性率达39.6%,术后8周行子宫切除术,38.5%有残存病灶。Parson(1978)报道锥切后残余或复发癌为3.2%~9.1%。Coppleson等(1992)收集13位作者的资料,术后残存病灶达12%~60%。Chang曾研究172例宫颈锥切后子宫切除的病理标本,发现锥切边缘阳性和残存病灶的发生率,在高度鳞状上皮内病变(HSIL,包括Ⅱ、Ⅲ级)中分别为18.6%和23.3%,残存病变在锥切边缘阳性中的比例显著高于边缘阴性者,分别为84.8%和10.1%。可见锥切治疗原位癌是不彻底的,并有遗漏浸润癌的可能。近年也有不少报道传统锥切术(CKC)成功地治疗宫颈原位癌(Mohamed等,1997)。 综上所述,CIN的治疗也应遵循个体化原则,治疗方法的选择主要取决于CIN的级别、病变范围、年龄、生育要求、医疗条件及医师的经验等。总的治疗对策为:对CINⅠ、Ⅱ级,采用冷冻、激光等局部治疗;对CIN Ⅲ级,国内以手术切除子宫为主,国外有主张采用局部治疗者。对年轻、有生育要求、病变范围小的CINⅠ级患者可以随访观察,而对病变局限、年轻、有生育要求或要求保留子宫的CIN Ⅲ级者可行锥形切除。 局部治疗CIN的效果主要与下列因素有关:①CIN级别,病变大小;②治疗深度;③整个转化区是否被去除;④合并反复或持续HPV感染(尤其高危型HPV);⑤颈管是否受累;⑥治愈标准、随诊时间、医师经验等。 因此,采用局部治疗需注意以下几点:①治疗前必须详细检查,准确诊断,并须排除浸润癌;②治疗前应做ECC检查;③月经干净后5~7天后进行;④宜在碘染、VIA或阴道镜直视下治疗;⑤治疗达足够深度,不应少于4mm,治疗范围应包括宫颈的全部病变(以超出病变3~5mm为宜)、整个转化区及颈管下段;⑥治疗后应长期随诊,包括细胞学、阴道镜和病理。 2.CIN常用的治疗方法 (1)冷冻治疗(cryosurgery):冷冻治疗CIN的文献报道较多,CINⅠ、Ⅱ级的治愈率可达90%~97%,而CIN Ⅲ级的治疗效果较差,80%~90%,但也有报道达96%(Levine,1985)。Coppleson等(1992)统计15位作者的治疗结果,总治愈率为83.5%,其中CINⅡ、Ⅲ级的治愈率分别为91%和77.8%,说明随CIN级别的增加治愈率明显下降。 冷冻治疗简易有效,冷冻最大的优点就是没有电灼所产生的疼痛。治疗深度与电灼一样,也可达3~4mm。不过,少数病人因为需要重复治疗,尤其在行深部治疗时仍会感觉不舒服,可能是子宫收缩的结果。Richard等人以及其他报道最多的16位作者,都认为用冷冻治疗所有的CIN,失败率为1%~8%。其中CINⅠ是零失败率。值得注意的是,失败后再次冷冻治疗可减少CINⅡ的失败率到3%,减低CIN的失败率到7%。冷冻所采用的冷煤、二氧化碳(carbon dioxide)或一氧化氮(nitrousoxide),结果都是一样。惟治疗时,压力不能低到40kg/cm2。与子宫颈接触的探头(probe)部分,除了中间呈乳突状外,四周应该是4~5mm宽。同时,为了均匀及快速冷冻,探头部分可抹上一层薄薄的水溶性润滑油,则更为理想。 一般认为冷冻治疗宜用于病变局限的CINⅠ、Ⅱ级,为提高治愈、减少复发,冷冻治疗需注意以下几点: ①根据宫颈形态及病变范围等选用相应的冷冻头,应以覆盖整个病灶为宜。冷冻头端应涂一薄层水溶性润滑剂作为介质,提高穿透性,增加与宫颈的均匀接触,使温度迅速传递。 ②冷冻剂用CO2或液氮,温度在-75℃以下,压力是冷冻成败的重要因素,必须始终保持在3.92×106Pa(40kgf/cm2)以上,以保证冷冻能力,探头周围要在1.5~2min内形成保持4~5mm厚度的冷球。 ③应用两次即两个冻融期,以达到较好疗效。 (2)激光治疗:Bellina和Poleshchuk等于20世纪70年代应用CO2激光治疗妇科肿瘤,80年代国内外文献报道治疗CIN的效果,Towensend(1983)比较激光和冷冻治疗CIN(各100例)的结果,失败率分别为11%和7%。Coppleson综合文献一次治愈率为76%~98%。上海医科大学妇产医院报道用激光治疗CIN 220例,转常率为65.5%,高于其他疗法,复发率为5.8%。 激光一般都在阴道镜下操作,所放出的能量由点状光束释出,并由组织吸收,除可摧毁组织并可将其蒸发。激光的触煤也是二氧化碳。连续的治疗比断续的治疗效果要好。深度可达5~7mm。惟治疗时不可用易燃物品,例如酒精、消毒剂等。此外,治疗时产生的烟雾可用吸管吹掉,让视野更清楚一些。除了有组织破坏较深的好处之外,激光至少有两种坏处:比电灼、冷冻还要痛,这是深部组织破坏后的必然现象,也因此而出血较多。依Parashevadis等人的报道,总失败率是5.6%(119/2130)。在40岁 (3)年龄:随年龄增长,CIN病变的逆转率下降。Mill等发现35~39岁CIN患者的总逆转率为77%,40岁以上则为61%。 (4)其他:如CIN的干预治疗、随诊时间等。 2.关于SPI的转归 多数学者认为SPI具有与CIN相似的临床和生物学特性,目前对SPI的转归虽有争议,但20世纪80年代以来的几组报道提示HPV也有三种转归,且与HPV的型别有关。Rome和Chanan等(1987)报告259例未治疗的SPI,随诊18个月,其中16%有进展,39%持续不变,45%消退。Syrjanen等(1987)报道宫颈细胞学诊断HPVⅠ的513例中,25%进展为CIN,60%持续不变,14%消退。 3.宫颈原位癌的转归 多数认为原位癌可进展为浸润癌,仅少数自然消退或经活检后消失,也有作者认为原位癌不会自然消退。Mcindoe等(1984)报道300例未治疗的原位癌,随访10~20年,转浸润癌率分别为18%和36%。杨学场等(1992)观察了69例拒绝治疗的原位癌患者,其中26%在平均5.2年内发展为浸润癌。
(3)年龄:随年龄增长,CIN病变的逆转率下降。Mill等发现35~39岁CIN患者的总逆转率为77%,40岁以上则为61%。 (4)其他:如CIN的干预治疗、随诊时间等。 2.关于SPI的转归 多数学者认为SPI具有与CIN相似的临床和生物学特性,目前对SPI的转归虽有争议,但20世纪80年代以来的几组报道提示HPV也有三种转归,且与HPV的型别有关。Rome和Chanan等(1987)报告259例未治疗的SPI,随诊18个月,其中16%有进展,39%持续不变,45%消退。Syrjanen等(1987)报道宫颈细胞学诊断HPVⅠ的513例中,25%进展为CIN,60%持续不变,14%消退。 3.宫颈原位癌的转归 多数认为原位癌可进展为浸润癌,仅少数自然消退或经活检后消失,也有作者认为原位癌不会自然消退。Mcindoe等(1984)报道300例未治疗的原位癌,随访10~20年,转浸润癌率分别为18%和36%。杨学场等(1992)观察了69例拒绝治疗的原位癌患者,其中26%在平均5.2年内发展为浸润癌。